|
O mundo em que vivemos apresenta uma grande variedade de formas, cores, temperaturas, movimentos. Através dos órgãos dos sentidos, percebemos coisas que podemos tocar ( uma pessoa, uma planta, uma pedra ) e outras que apenas sentimos ( o ar, a umidade ). O que todas essas coisas têm em comum? Por mais diferentes que possam parecer, todas ocupam um lugar no espaço. Todas são feitas de matéria.
Tudo que possui massa e ocupa um lugar no espaço recebe o nome de matéria
No universo, a matéria não pode ser criada nem destruída, mas apenas transformada. Existe outro componente do universo que não é matéria, embora esteja intimamente ligado a ela: é a energia. Formas de energia, como a luz, o som e o calor, não são consideradas matéria, pois não possuem massa nem ocupam lugar no espaço. Em linguagem científica, dizemos que a energia é a capacidade de realizar um trabalho. Vejamos estes exemplos:
Às vezes, percebemos a energia através dos nossos órgãos dos sentidos. Sentimos o calor, ouvimos o som, enxergamos a luz. Outras vezes, não somos capazes de percebê-la. É o caso da energia atômica, que não pode ser sentida diretamente, mas apenas através de suas conseqüências: uma usina nuclear, por exemplo, transforma a energia atômica em energia elétrica. Assim como a matéria, a energia existente no Universo não pode ser criada nem destruída, mas apenas transformada. Exemplos: transformação da energia dos alimentos em movimento; da energia elétrica em calor e luz; etc.
A matéria pode aparecer no Universo de diversas maneiras. Pode apresentar diferenças em sua composição ou em seu tamanho ( seu volume ). Isto quer dizer que a matéria varia em substância e se apresenta em diferentes corpos. Cada substância é um determinado tipo de matéria. Corpo é uma porção limitada de matéria.
Todos os corpos produzidos pelo homem e que possuem alguma utilidade recebem o nome de objeto. Na maioria dos casos, os corpos são constituídos de uma mistura de substâncias. Na madeira, por exemplo, encontramos substâncias como a celulose, a lignina, a água, etc.
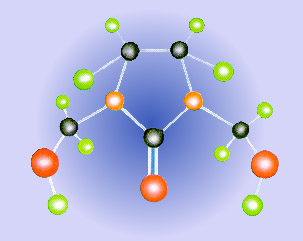
A matéria forma corpos. Mas existiria algo menor que forma a matéria? Moléculas Se, por exemplo, pudéssemos dividir uma porção de água em porções cada vez menores, em escala microscópica, iríamos encontrar a menor estrutura possível de substância água. Encontraríamos a molécula de água. Molécula é a menor parte de uma substância e que ainda conserva a mesma composição dessa substância. Átomos Continuando a dividir a matéria, o que viria depois da molécula? O átomo.
Átomos são partículas que formam as moléculas.
De um modo geral, as partículas que compõem uma substância podem se organizar de diferentes formas. Essas diferentes formas estão relacionadas ao seu estado físico. As partículas podem estar mais unidas ou mais afastadas, de acordo com as condições de temperatura e de pressão a que a matéria esteja sendo submetida. Alterando essas condições, podemos efetuar mudanças no estado físico da matéria. Basicamente, os estados físicos da matéria são três: sólido, líquido e gasoso.
Nos corpos sólidos, as partículas que os constituem ficam muito próximas umas das outras. No estado sólido a matéria:
Na maioria dos casos, corpos sólidos se transformam em líquidos ou gasosos quando aquecidos a temperatura elevada ou quando a pressão a que estão submetidos é reduzida.
No estado líquido, em geral, a matéria apresenta suas partículas mais afastadas umas das outras do que no estado sólido. Isso permite que elas se movimentem, tornando a matéria fluida. No estado líquido, a matéria é geralmente constituída por moléculas e:
Em condições ambientais, a matéria no estado gasoso é constituída por átomos ou moléculas, que estão bem afastados uns dos outros, permitindo a sua grande movimentação. No estado gasoso, a matéria:
Já sabemos que dois fatores influem na mudança de estado físico da matéria: a temperatura e a pressão.
O aumento da temperatura faz com que as moléculas ou partículas da matéria se movimentem com maior velocidade. Já o aumento da pressão faz com que as moléculas fiquem mais próximas. Um atua contrariamente ao outro. Se quisermos manter a matéria no mesmo estado físico, devemos compensar qualquer mudança nas condições de pressão com outra mudança de temperatura, e vice-versa. Vamos ver como tudo isso acontece.
Fusão é a passagem de uma substância do estado sólido para o estado líquido. Os sólidos puros sofrem fusão sempre a uma temperatura e pressão determinadas. A essa temperatura chamamos ponto de fusão. Até o fim de todo o processo de fusão, essa temperatura permanece inalterada. Veja, na tabela abaixo, qual é o ponto de fusão de algumas substâncias, à pressão normal ( 1 atm ). Pressão normal é, aproximadamente, a pressão atmosférica ao nível do mar ( a pressão atmosférica varia com as condições climáticas ). Sua medida é de 1 atmosfera 1 ( atm ). Aumentando a altitude, a pressão atmosférica diminui.
Embora o ponto de fusão seja pouco sensível ao efeito da pressão, podemos alterar o ponto de fusão de uma substância alterando a pressão exercida sobre ela. De um modo geral, quanto maior a pressão que exercemos sobre um sólido, mais alto se tornará seu ponto de fusão. Algumas poucas substâncias têm seu ponto de fusão abaixado com o aumento de pressão, como o gelo, por exemplo.
Solidificação é a transformação de uma substância do estado líquido para o estado sólido. É o processo inverso da fusão. O ponto de solidificação é o mesmo que o de fusão. Como na fusão, a temperatura permanece constante durante todo processo.
Vaporização é a transformação de uma substância do estado líquido para o estado gasoso. Existem dois tipos de vaporização: ebulição e evaporação. A ebulição ocorre quando fornecemos calor a um líquido ou reduzimos a pressão que atua sobre ele. Colocando-se uma panela com água começará a ferver, isto é, entrará em ebulição, e bolhas de vapor se formarão em toda a parte líquida. Durante todo processo de ebulição, ou seja, até que todo líquido se vaporize, a uma pressão constante, a temperatura permanece constante. A essa temperatura denominamos ponto de ebulição, que é particular a cada líquido puro.
Ao contrário do ponto de fusão, o ponto de ebulição é bastante sensível à variação da pressão externa. O aumento da pressão externa faz com que o ponto de ebulição de um líquido puro aumente, ocorrendo o inverso quando a pressão externa é diminuída. A evaporação é a mudança lenta de uma substância líquida em vapor. Pode ocorrer espontaneamente, dependendo das condições ambientes. Podemos constatar a evaporação na secagem de roupas no varal, de poças de água, da água das chuvas, dos rios, etc. Fatores que favorecem a evaporação:
Condensação é a mudança de uma substância do estado gasoso para o estado líquido.
Você já teve oportunidade de observar que a tampa da panela em que cozinhamos alimentos fica cheia de gotinhas de água? Você sabe por que isso ocorre? Durante a ebulição, a água se transforma em vapor que, ao tocar a superfície fria da tampa volta novamente ao estado líquido. É o fenômeno da condensação, também chamado de liquefação. Numa determinada pressão, cada substância se condensa a uma determinada temperatura. É o seu ponto de condensação, que é igual ao ponto de ebulição.
Sublimação é a passagem direta de uma substância do estado sólido para o estado de vapor, e vice-versa. Você já deve ter observado que as bolinhas de naftalina colocadas em gavetas diminuem de tamanho com o tempo. Por que isso acontece? Existem substâncias sólidas, como a naftalina, a cânfora, o benjoim e o iodo, que nas condições habituais de pressão e temperatura em que vivemos se transformam espontaneamente em vapor, sem passar pelo estado líquido. Quando o vapor dessas substâncias se resfria pode ocorrer o fenômeno inverso: voltam ao estado sólido. Ambos os fenômenos chamam-se sublimação. |
 A MATÉRIA
A MATÉRIA
 A substância plástico, por exemplo, pode aparecer
em vários corpos: bolas de brinquedo, embalagens, vasilhas, películas, etc. a
substância água, por sua vez, pode aparecer isoladamente ou na composição do ar
e das células vivas, etc.
A substância plástico, por exemplo, pode aparecer
em vários corpos: bolas de brinquedo, embalagens, vasilhas, películas, etc. a
substância água, por sua vez, pode aparecer isoladamente ou na composição do ar
e das células vivas, etc.