Propriedades Gerais e Específicas da Matéria
|
|
Propriedades da matéria
As substâncias possuem algumas propriedades que podem ser comuns as de outras substâncias ou que podem diferenciá-las. Por exemplo, o limão e a laranja são substâncias ácidas; esta é então uma propriedade comum entre tais frutas, no entanto, o cheiro de ambas é bem característico de cada uma.
É muito importante determinar essas propriedades. Por exemplo, se ocorrer um assassinato, a fim de se identificar o autor são coletadas pistas, como substâncias presentes no local do crime, e são feitos cuidadosos experimentos para identificar essas substâncias e assim relacioná-las ao criminoso. Assim, por meio de suas propriedades, identificam-se substâncias presentes em alimentos, medicamentos, substâncias tóxicas, tecidos de roupas, entre outros.
|
As propriedades dos compostos são caracterizadas pelo comportamento deles quando submetidos a agentes como calor, luz, contato com outras substâncias, etc.
|
Existem vários tipos de propriedades, entre elas temos as apresentadas e explicadas abaixo:
Propriedades gerais da matéria
A matéria tem oito propriedades gerais, isto é, oito características comuns a toda e qualquer porção de matéria: inércia, massa, extensão, impenetrabilidade, compressibilidade, elasticidade, divisibilidade e descontinuidade.
|
1) Inércia: A matéria conserva seu estado de repouso ou de movimento, a menos que uma força aja sobre ela. No jogo de sinuca, por exemplo, a bola só entra em movimento quando impulsionada pelo jogador, e demora algum tempo até parar de novo. |
|
|
|
2) Massa: É uma propriedade relacionada com a quantidade de matéria e é medida geralmente em quilogramas. A massa é a medida da inércia. Quanto maior a massa de um corpo, maior a sua inércia. Massa e peso são duas coisas diferentes. A massa de um corpo pode ser medida em uma balança. O peso é uma força medida pelos dinamômetros. |
|
3) Extensão: Toda matéria ocupa um lugar no espaço. Todo corpo tem extensão. Seu corpo, por exemplo, tem a extensão do espaço que você ocupa. |
|
|
|
4) Impenetrabilidade: Duas porções de matéria não podem ocupar o mesmo lugar ao mesmo tempo. Comprove a impenetrabilidade da matéria: ponha água em um copo e marque o nível da água com esparadrapo. Em seguida, adicione 3 colheres de sal. Resultado: o nível da água subiu. Isto significa que duas porções de matéria (água e sal), não podem ocupar o mesmo lugar no espaço (interior do copo) ao mesmo tempo. |
|
5) Compressibilidade: Quando a matéria está sofrendo a ação de uma força, seu volume diminui. Veja o caso do ar dentro da seringa: ele se comprime. |
|
|
|
6) Elasticidade: A matéria volta ao volume e à forma iniciais quando cessa a compressão. No exemplo anterior, basta soltar o êmbolo da seringa que o ar volta ao volume e à forma iniciais. O mesmo acontece quando o elástico é esticado. |
|
7) Divisibilidade: A matéria pode ser dividida em partes cada vez menores. Quebre um pedaço de giz até reduzi-lo a pó. Quantas vezes você dividiu o giz !? |
|
|
|
8) Descontinuidade: Toda matéria é descontínua, por mais compacta que pareça. Existem espaços entre uma molécula e outra e esses espaços podem ser maiores ou menores tornando a matéria mais ou menos dura. |
Propriedades específicas da matéria
Existem propriedades que são características de algumas matérias. Por exemplo, o ouro apresenta propriedades que o ferro não possui. Ele e o ferro apresentam propriedades que a água não tem. Já a água apresenta propriedades não encontradas no oxigênio, e assim por diante. Isso ocorre porque as substâncias ouro, ferro, água, oxigênio etc. são diferentes entre si.
As propriedades específicas nos permite distinguir uma substância de outra. Dentre as propriedades específicas, podemos citar:
1) Propriedades organolépticas:
São aquelas que percebemos pelos nossos sentidos, como o sabor, o cheiro, o odor e a cor. Por exemplo, podemos distinguir um anel de ouro de um de prata simplesmente pela cor.
No entanto, apesar de serem úteis, essas propriedades nem sempre podem ser utilizadas para a identificação de determinados compostos. Como não sabemos de que material se trata, não podemos cheirá-lo ou ingeri-lo, pois tais ações podem ser potencialmente tóxicas e fatais.
| A) Cor: a matéria pode ser colorida ou incolor. Esta propriedade é percebida pela visão. | B) Brilho: a capacidade de uma substância de refletir a luz é a que determina o seu brilho. Percebemos o brilho pela visão. |
| C) Sabor: uma substância pode ser insípida (sem sabor) ou sápida (com sabor). Esta propriedade é percebida pelo paladar. | D) Odor: a matéria pode ser inodora (sem cheiro) ou odorífera (com cheiro). Esta propriedade é percebida pelo olfato. |
|
|
|
2) Propriedades Físicas:
Dizem respeito a características inerentes ou particulares, que independem da transformação da substância com outras. São fenômenos de medidas físicas, como a densidade, os pontos de fusão e ebulição, o calor específico, a solubilidade, dureza, etc.
Por exemplo, o ponto de ebulição do éter não é o mesmo que o do óleo lubrificante para automóveis. O éter tem a propriedade física de se evaporar facilmente, enquanto que com o óleo isto não ocorre.
Essa propriedade é muito importante principalmente para a identificação das substâncias.
|
A) Densidade: é o resultado da divisão entre a quantidade de matéria (massa) e o seu volume. A densidade absoluta de um corpo é igual a m/v. Se a massa é medida em gramas e o volume em cm cúbicos, a densidade é obtida em gramas por cm cúbicos. Ex: Qual a densidade de um corpo que tenha massa de 200 g e está ocupando um volume de 2000 cm cúbicos ? É de 0.1 g/cm cúbico. |
|
|
|
B) Ponto de Fusão e Ebulição: Entende-se por ponto de fusão a temperatura em que uma substância passa do estado sólido passa o estado líquido, e por ponto de ebulição a temperatura em que uma substância líquida passa para o estado gasoso, à determinada pressão. Por exemplo, a água pura passa do estado sólido para o estado líquido, sob pressão de 1 atm, à temperatura de 0 ºC. Diz-se assim que o Ponto de Fusão da água pura é 0 ºC. Já essa água pura passa do estado líquido para o estado gasoso, sob a mesma pressão, à temperatura de 100 ºC. Diz-se assim que o Ponto de Ebulição da água pura é 100 ºC |
|
C) Calor Específico: O calor específico é definido como a quantidade de energia necessária para que 1 g de uma substância sofra aumento ou diminuição de temperatura de 1°C. |
|
|
|
D) Solubilidade: Para formarmos uma solução, precisamos adicionar uma porção de soluto (substância que será dissolvida) numa quantidade de solvente (substância presente em maior quantidade, que dissolverá o soluto). A capacidade que uma substância apresenta de ser dissolvida em outra recebe o nome de solubilidade. |
|
E) Dureza: é a resistência que a superfície de um material tem ao risco. Um material é considerado mais duro que o outro quando consegue riscar esse outro deixando um sulco. Para determinar a dureza dos materiais, usamos uma escala de 1 a 10. O valor um corresponde ao mineral menos duro que se conhece, o talco. O valor 10 é a dureza do diamante, o mineral mais duro que se conhece. |
|
3) Propriedades Químicas:
São aquelas relacionadas às transformações químicas que as substâncias sofrem, ou seja, são transformações que alteram as suas constituições. Por exemplo, o ferro enferruja, no entanto, isso dificilmente ocorre com o ouro. Outro exemplo: o álcool sofre combustão, a água não.
 |
 |
 |
|
Pregos enferrujados |
Álcool sofrendo combustão |
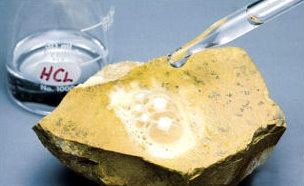
Alguns minerais fazem efervescência quando reagem com o ácido clorídrico, devido à libertação de dióxido de carbono. É o caso, por exemplo, da calcita. |
Principais Fontes de Pesquisa:
http://www.sobiologia.com.br
http://alunosonline.uol.com.br
http://www.infoescola.com/
http://mundoeducacao.bol.uol.com.br/
http://www.coladaweb.com